La metalúrgia Ia podemos definir como la ciencia, tecnología y arte de trabajar los metales desde su obtención y a partir de los minerales, hasta la fabricación de los productos finales.
Las propiedades de los metales y sus aleaciones dependen de sus estructuras metalúrgicas las cuales son las que se pueden examinar por medio del microscopio, como los patrones geométricos en que los átomos están dispuestos en los metales. Por tanto, el estudio de la metalúrgia comienza necesariamente con la descripción de estos patrones.
ESTADOS DE LA MATERIA.
Existen muchos estados de la materia pero ahora nos vamos a centrar en los tres estados de agregación de la materia que son gas, líquido y sólido. La diferencia entre estos estados radica principalmente en la movilidad de los átomos, la separación entre ellos y el orden (o desorden) con que se encuentran dispuestos en cada uno de los casos.
En los gases existe gran movilidad debido a que la separación entre los átomos es relativamente grande, de manera que estos interactúan con gran desorden, moviéndose libremente.
En el estado líquido las moléculas (Se conoce como moléculas a grupos de más de un átomo) se mueven más lentamente que en los gases, las fuerzas de atracción moleculares son capaces de mantenerlas juntas dentro de un volumen definido. Sin embargo, el movimiento molecular es lo bastante rápido como para provocar que estas moléculas no puedan fijarse dentro de posiciones definidas como sucede en los sólidos.
En el estado sólido, en cambio, los átomos están dispuestos de manera ordenada, ocupando posiciones fijas, conformando estructuras definidas; la distancia entre un átomo y el otro es más reducida (con respecto a los otros estados) y su movilidad es muy limitada.
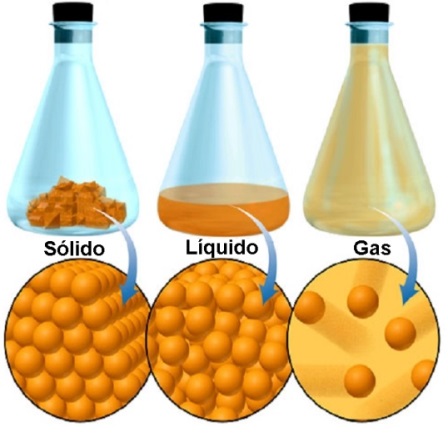
Estados de agragación de la materia
Si un sólido se forma rápidamente sus átomos o moléculas no tienen tiempo de alinearse por sí mismos y pueden quedar fijos en posiciones distintas a las de un cristal ordenado. El sólido así formado se llama amorfo. Los sólidos amorfos, como el vidrio, carecen de una distribución tridimensional regular de átomos y se caracterizan por que permiten el paso de la luz.
PROPIEDADES DE LOS METALES
Como todo material usado en la construcción, los metales poseen unas propiedades exlusivas de cada uno, lo que proporciona una gran variedad de opciones al momento de realizar un proyecto. Acorde a la metalúrgia l as propiedades se pueden clasificar en fisicoquímicas, mecánicas y tecnológicas. A continuación, explicamos cada una de ellas.
Propiedades fisicoquímicas en la metalúrgia.
Son varias, dependen del tipo de aleación, las más importantes son: Peso específico, calor específico, temperaturas de fusión y evaporación, conductividad térmica y conductividad eléctrica.
Peso específico.
Puede ser absoluto o relativo, el primero se calcula como el peso por unidad de volumen de una sustancia homogénea. El segundo se calcula como la relación entre el peso de un cuerpo y el peso de un volumen igual de una sustancia tomada como referencia.
Calor específico.
Es la cantidad de calor necesaria para elevar un kilogramo de sustancia en un grado centígrado.
Temperaturas de fusión y evaporación.
Son las temperaturas a las cuales la sustancia pasa de sólido a líquido, y de líquido a gas, esto se logra mediante la adición de calor.
Conductividad térmica.
Es la capacidad que tiene un elemento de conducir el calor, físicamente es la capacidad de una sustancia de transferir energía cinética de una de sus moléculas a las moléculas adyacentes.
Conductividad eléctrica.
Es la medida de la capacidad de una sustancia de dejar pasar o circular libremente una corriente eléctrica, dependen de la estructura atómica y molecular del material.
Propiedades mecánicas en la metalúrgia.
Son las propiedades del material que se oponen a todo tipo de esfuerzo que tiende a alterar su forma, las más importantes son dureza, resistencia, elasticidad, plasticidad, tenacidad, fragilidad, fluencia y fatiga.
Dureza.
Es la resistencia que oponen los cuerpos al ser rayados o penetrados; cuanto mayor sea la cohesión entre los átomos, mayor es la dureza. La cohesión es la resistencia que oponen los átomos del material a ser separados. Cabe ampliar que existen varios métodos o ensayos para conocer la dureza de un material, entre los más comunes tenemos:
Dureza Brinell.
Emplea como punta una bola de acero templado o carburo de wolframio, Dureza Knoop. Mide la dureza en valores de escala absolutas, y se valoran con la profundidad de señales grabadas sobre un mineral mediante un utensilio con una punta de diamante al que se le ejerce una fuerza estándar, Dureza Rockwell. Se utiliza como punta un cono de diamante (en algunos casos bola de acero). Es la más extendida, ya que la dureza se obtiene por medición directa y es apto para todo tipo de materiales. Se suele considerar un ensayo no destructivo por el pequeño tamaño de la huella, Dureza Shore. Emplea un escleroscopio. Se deja caer un indentador en la superficie del material y se ve el rebote. Es adimensional, pero consta de varias escalas. Es un método elástico, no de penetración como los otros, Dureza Vickers. Emplea como penetrador un diamante con forma de pirámide cuadrangular.
Resistencia.
Es la capacidad de soportar una carga externa sin rotura, puede ser carga a tracción, compresión, flexión, torsión y cizallamiento.
Elasticidad.
Los materiales que sufren un esfuerzo (Se entiende por esfuerzo el conjunto de fuerzas y momentos estáticamente equivalentes a la distribución de tensiones internas sobre el área de una sección) y se deforman, pueden recobrar su forma inicial o no recobrarla, esto diferencia a los materiales elásticos y los materiales plásticos. Además, muchos materiales pueden ser elásticos hasta cierto nivel de deformación y a partir de ahí, ser plásticos.
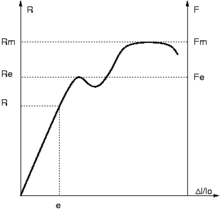
Diagrama esfuerzo deformación.
La elasticidad es la propiedad que tienen los materiales que sufren una deformación, de recobrar su forma al momento que se elimina la carga que lo ha deformado. Cuando se encuentra entre el punto en que el cuerpo ya no vuelve a su forma inicial y el punto de rotura de este el elemento pasa de la deformación elástica a la deformación plástica. Esta propiedad tiene dos variantes:
Ductilidad.
Capacidad de estirarse en forma de hilo.
Maleabilidad.
Capacidad para transformarse en láminas.
Tenacidad.
Es la resistencia que ofrece un material a la rotura cuando se le aplica una carga de impacto. Los materiales tenaces se distinguen por tener el punto elástico y el de rotura muy distanciados, dado que tienen un periodo de elasticidad muy largo.
Fragilidad.
Es la propiedad contraria a la tenacidad; que se expresa por falta de plasticidad, la poseen los materiales carentes de resistencia al choque.
Fluencia.
Es la propiedad de un material de deformarse por su propio peso o por cargas muy pequeñas, algunas veces la denominan creep.
Fatiga.
Es la resistencia de un material a las cargas externas alternativas o intermitentes.
Propiedades tecnológicas en la metalúrgia.
Son las relativas al grado de adaptación del material frente a distintos procesos de trabajo a los que puede estar sometido. Las más importantes son:
Maquinabilidad.
Mayor o menor facilidad al labrado por herramientas o cuchillas de corte.
Colabilidad.
Mayor o menor facilidad a llenar bien un molde cuando está en estado líquido.
Soldabilidad.
Capacidad de un material para dejarse soldar fácilmente.
Ductilidad.
Aptitud para la deformación de un metal en forma de hilo.
Maleabilidad.
Capacidad de un metal para ser deformado en láminas.
Templabilidad.
Aptitud que tienen los metales para dejarse penetrar por el temple.
Tal vez te interese también la segunda parte de este artículo. Da clic acá para conocer más.
ESTRUCTURAS CRISTALINAS
La diferencia principal entre los otros estados y el sólido consiste en que en los sólidos los átomos están dispuestos o empaquetados ordenadamente según modelos geométricos tridimensionales bien definidos, a esta configuración se le llama estructura cristalina o cristal. Estas siguen uno de los modelos geométricos de una red espacial en la que un átomo o grupo de átomos ocupan las posiciones indicadas por los puntos de la red.
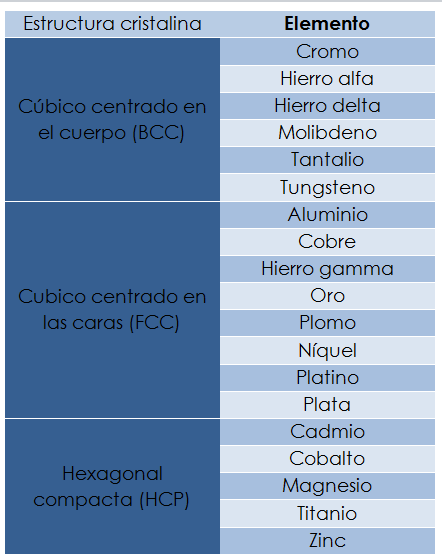
En la metalúrgia existen 14 redes espaciales simples y un número ilimitado de estructuras cristalinas posibles pero en nos enfocaremos a las más comúnmente encontradas en los metales: la cúbica centrada en el cuerpo (BCC Por sus siglas en inglés Body-centered cubic), la cúbica centrada en las caras (FCC Por sus siglas en ingles Face-centered cubic) y la hexagonal compacta (HCP Por sus siglas en ingles Hexagonal close-packet).



Imagen tomada de https://www.nde-ed.org/Physics/Materials/Structure/metallic_structures.xhtml
Algunos metales tales como el hierro existen como una fase sólida a temperatura ambiente y como otra fase sólida a temperaturas elevadas, los metales que tienen estos cambios estructurales se conocen como metales alotrópicos.
A continuación se muestra una tabla con los metales más comunes agrupados según su estructura cristalográfica.
Las acomodaciones cristalográficas citadas anteriormente son muy útiles para entender la conformación de los metales, pero en la práctica estos son cristales ideales no existen debido a que presentan unas imperfecciones y discontinuidades se encuentran en las zonas de ordenamiento de largo alcance conocidas como granos.
Estas imperfecciones o defectos pueden ser puntuales o lineales.
DEFECTOS PUNTUALES EN LA METALÚRGIA.
Pueden involucrar uno o varios átomos, se pueden generar en el material cuando hay una adición de energía por calentamiento, durante su procesamiento, introducción de impurezas y/o intencionalmente en la adición de aleaciones acorde a la metalúrgia existen los siguientes tipos.
Vacancias.
Es la falta de un átomo en un sitio normal de la red, a temperatura ambiente aparecen muy pocas vacancias pero estas se incrementan a medida que aumenta la temperatura, se pueden generar como consecuencia de daños por radiación o en el momento de la solidificación a altas temperaturas.

Vacancia en la estructura cristalina.
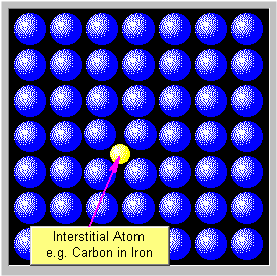
Átomo intersticial.
Se forma un defecto intersticial cuando se inserta un átomo adicional en una posición normalmente desocupada dentro de la estructura cristalina. Los átomos intersticiales pueden ser más pequeños o más grandes que los átomos localizados en los puntos de la red que ocupan; como consecuencia la red circundante aparece comprimida y distorsionada.

Átomo intersticial en estructura cristalina
Átomo sustitucionales.
Se crea un defecto sustitucional cuando se remplaza un átomo por otro de un tipo distinto. El átomo sustitucional permanece en la posición original y no en los intersticios. Cuando estos átomos son mayores que los normales de la red, los átomos circundantes se comprimen; si son más pequeños, los átomos circundantes quedan en tensión.
Defecto sustitucional en la estructura cristalina.
DEFECTOS LINEALES EN LA METALÚRGIA.
Son también conocidas como dislocaciones y se pueden clasificar en dislocación de tornillo o dislocación de borde, son de gran importancia ya que aumentan la ductilidad de los metales, estas dislocaciones son la razón por la cual las resistencias de los metales son menores que el valor predecible a partir del enlace metálico, esto se explica ya que si ocurre el deslizamiento solo es necesario que se rompa una pequeña fracción de todas las uniones metálicas a través de la interface y en caso de que se necesite reducir los efectos de las dislocaciones se pueden adicionar elementos que se ubiquen en los intersticios de la estructura y así hacer más difícil el movimiento de las dislocaciones.
Dislocación de tornillo.
La dislocación de tornillo se puede ilustrar haciendo un corte parcial a través de un cristal perfecto, torciéndolo y desplazando un lado del corte sobre el otro la distancia de un átomo.

Representación de una dislocación de tornillo en la estructura cristalina.
Dislocación de borde.
Una dislocación de borde se puede ilustrar haciendo un corte parcial a través de un cristal perfecto, separándolo y rellenando parcialmente el corte con un plano de átomos adicional. El borde inferior de este plano adicional representa la dislocación de borde.

Representación de una dislocación de borde en la estructura cristalina